МОРФОЛОГО- ФИЗИОЛОГИЧЕСКИЕ ХАРАКТЕРИСТИКИ ДРОЖЖЕВЫХ ОРГАНИЗМОВ –MALASSEZIA SPECIES
ПРОБЛЕМЫ МЕДИЦИНСКОЙ МИКОЛОГИИ, 2011, Т.13, №1
НИИ медицинской микологии им.П.Н.Кашкина ГОУ
ДПО СПб МАПО, Санкт-Петербург, Россия
© Богданова Т.В., Елинов Н.П., 2011
Заболевания, вызываемые Malassezia spp., именуют малассезиозом.
В предшествующие годы названия были другими и, нередко, не полностью адекватными; теперь это синонимы малассезиоза – Dermatomycosis furfuracea, «Liver spots», Pityriasis versicolor, Tinea flava, Tinea versicolor.
Тем не менее, отметим, что прежде, чем было предложено родовое название микромицета Malassezia, впервые идентифицированного французским учёным Louis-Charles Malassez в конце ХIХ в., Р. Сабуро определил вызывающий перхоть организм в начале ХХ в. и назвал его Pityrosporum malassez, то есть не на уровне рода, а вида.
Когда было доказано, что оба организма (Malassezia и Pityrosporum) являются тождественными, термину «Malassezia», по праву приоритетности [1], отдали предпочтение. В середине ХХ в. Malassezia была реклассифицирована на два вида:
• Pityrosporum (Malassezia) ovalе, являющимся липидозависимым и обнаруживаемым только у людей. Позже P. ovale подразделили на два вида – P. ovale и P. orbiculare, но большинство авторов сходятся во мнении о принадлежности этих терминов одному виду гриба с предпочтительным названием M. furfur [2].
• Pityrosporum (Malassezia) pachydermatis, являющимся липофильным, но не липидозависимым.
Его обнаруживают на коже у большинства представителей животных. К концу 90-х годов исследователи из института им. Луи Пастера (Париж, Франция) открыли новые виды малассезий и довели их общее число до 10 [3]:
•
М. dermatis,
•
M. furfur,
•
M. globosa,
•
M. nana,
•
M. obtusa,
•
M. pachydermatis,
•
M. restricta,
•
M. slooffiae,
•
M. sympodialis,
•
M. yamatoensis.
В другие годы род Malassezia возрос до 13 видов + M. caprae, M. japonica [4-7] и M. cuniculi.
Очевидно, что следует ожидать в ближайшие годы определённых изменений и уточнений в составе данного рода, поскольку не все виды получили оценку завершённости в сравнительном плане между собой. Это, например, касается M. equina [8], недавно исключённой по формальным признакам из списочного состава малассезий, a M.cuniculi sp. nov., напротив, включена в него [9].
рис. 1. Дендрограмма с включением Malassezia equina
Удивительно то, что молекулярно-генетическая ветвь из 5 штаммов M. equina, хорошо вписанная между M. dermatis и M. caprae, оказалась исключённой, и, следовательно, недостаточно изученной. В этой связи мы приводим два рисунка молекулярно-генетических древ (Рис. 1 и 2) с наличием и отсутствием M. equina, и подчёркиваем, что работа с малассезиями в лабораторных и клинических условиях исключительно осложнена из-за трудностей их культивирования и сохранения.
Malassezia furfur – липофильный дрожжеподобный вид, являющийся представителем нормобиоты кожи человека.
Пролиферация М. furfur в роговой слой (stratum corneum) индуцирует возникновение Pityriasis versicolor (PV), характеризущийся бело-коричневыми или желтовато-коричневыми дискретными – до сливающихся поражениями, покрытыми тонкими чешуйками.
Хотя M. furfur появляется также в «закупоренных» волосяных фолликулах пациентов с фолликулитом, или Acne vulgaris (AV – угорь, или воспаление сальной железы и окружающей ткани), патогенетическая роль гриба при этом менее ясна – более очевидна ее роль при себорейном дерматите (СД).
Гриб вызывает катетер-приобретенную фунгемию у взрослых и, особенно, у новорожденных детей, получающих внутривенно «липидное питание». У таких пациентов случайно могут развиться малые эмболические поражения в лёгких и других органах.
М. pachydermatis – не частая причина катетерприобретенного сепсиса. M. sympodialis была изолирована с кожи головы пациента, страдавшего от СПИДа и, дополнительно, от дерматомикоза головы, но идентичность и этиологическое отношение гриба к данной патологии остаются под вопросом.
Ретроспективная оценка формирования рода Malassezia (по-лат. retrospicere – взгляд в прошлое) преимущественно согласно [10].
Гриб, вызывающий PV, определён Eichstedt в 1846 г., его также наблюдал и описал Sluyter в 1847 г. Эти авторы назвали заболевание PV, но не предложили название грибу – возбудителю.
В 1855 г. Robin назвал патоген Microsporum furfur, а заболевание – Tinea versicolor, предполагая при этом, что M. furfur сходен с дерматомицетом Microsporum audouinii [11].
Malassez в 1874 г. назвал «спорами» дрожжеподобные клетки из поражений на коже головы и из перхоти [12]. Bizzozero в 1884 г. наблюдал сферические и эллиптические дрожжеподобные клетки в эпидермальных чешуйках с тела человека [13]; он акцентировал внимание на том, что эти клетки были подобны «спорам» Малассеза и назвал сферические из них как Saccharomyces sphaericus, а овальные клетки – S. ovalis.
В 1889 г. Baillon признал тот факт, что этиологическим агентом PV является не Microsporum audouinii, а совсем другой организм, впервые названный им как Malassezia [14] и поставленный во главе рода.
В 1904 г. Cабуро [15] также изучил «споры Малассеза», связанные с питириазисом, и классифицировал их в ряду бластомицетов. Он назвал гриб Pityrosporum malassez, считая его причиной перхоти (pityriasis simplex capitis).
В 1913 г. Кастеллани и Чалмерс [16] приняли родовое название Pityrosporum и сформировали биноминал для «спор Малассеза» P. ovale. Видовой эпитет ovale был произведен от Saccharomyces ovale Вizzozero. Action и Рanja посчитали Pityrosporum синонимом Malassezia, но их таксономическая обработка двух родов не привлекала внимания более 30 лет.
Подчеркнём, что ни один из вышеназванных исследователей не культивировали гриб на липидосодержащей среде, хотя отдельные исследователи утверждали противное до 30-х годов ХХ столетия. «Липофильная природа» Malassezia spp. впервые была описана Родой Бенгэм [17] в 1939 г. В 1951 г. Гордон изолировал дрожжеподобный гриб и назвал его Pityrosporum orbiculare; он предположил, что P. orbiculare мог быть причинным агентом PV, и что он преждевременно был уравнен с Malassezia furfur [18].
Какие же главные доводы для оспаривания идентичности названных выше видов приводили сторонники данной позиции?
Организм из кожных чешуек в случаях с РV всегда содержал гифы и сферические почкующиеся клетки, тогда как в культуре обычно находились округлые клетки.
Экспериментальное введение лицам – волонтёрам или лабораторным животным P. orbiculare не сопровождалось возникновением и развитием PV. Круглые клетки, идентичные P. orbiculare, также легко изолировали из нормальной (не поражённой) кожи.
Однако Burke в 1961 г. смог вызвать клинический PV посредством инокуляции P. orbiculare на кожу лиц с высоким уровнем кортизона в плазме крови; этого не было на здоровых индивидуумах [19]. Очевидно, что Pityrosporum и Malassezia были синонимами, как это обнаружил Keddie с сотрудниками в течение первых лет 60-х годов. Sternberg и Кeddie применили метод флуоресцентных антител и определили те же антигенные компоненты у обеих вышеназванных культур [20].
В 1961 г. Keddie и Shadomy определили морфологическое и антигенное родство между P. orbiculare, выделенными в культуре из чешуек пациента с РV, и клетками Malassezia furfur, также найденными в чешуйках [21]. Эти находки были выполнены с использованием различных красителей грибов и с флуоресцентными антителами. Поскольку Action и Рanja раньше, чем Keddie предположили, что Pityrosporum и Malassezia – синонимы, а в 1977 г. Dorn и Roehnert, вырастившие клетки P. orbiculare с гифальными элементами на среде с глицином, солями, глюкозой и твином 80, с последующей электронной микроскопией, доказали идентичность проявлений организма в культуре и из клинических поражений при PV, а родовое название Malassezia Baillon 1889 имело приоритет над
Pityrosporum Sabouraud 1904, постольку принято название этиологического агента PV Malassezia furfur (Robin) Baillon, 1889.
Длительное время считали, что M. furfur – причина только поверхностной инфекции кожи, однако о её способности инвазировать глубокие ткани у взрослых было сообщено в 1981 г. [22], а позже – и у детей, получавших интравенозное лечение [23]. Диссеминированный малассезиоз у недоношенных новорожденных детей описан Shek и др. [24].
В настоящее время малассезии относят к представителям нормальной микробиоты кожи человека и теплокровных животных, у которых они также вызывают разные заболевания. Для выживания и роста Malassezia spp. необходимы липиды. Более того, они являются мезофилами, для которых оптимальная температура составляет 30–35 °С. Этими двумя физиологическими особенностями объясняют, почему Malassezia spp. известны только как возможные патогены кожи теплокровных животных (Рис. 3).
рис. 3. Malassezia furfur АТСС 15521 в сканирующем электронном микроскопе (после роста и развития в течение 5 суток на среде, содержащей глюкозу, лактозу, гидролизат казеина /триптон/, натрия хлорид, дистиллированную воду), х 5250
Ветеринары в течение длительного времени исследовали роль М. pachydermatis как патогена инфекций у собак. Недавно было сообщено о случаях, когда M. furfur и M. obtusa были изолированы в качестве патогенов отита наружного уха у собак, а M sympodialis в подобных условиях – у кошек. Липидозависимые Malassezia spp. также колонизируют кожу многих других животных: обезьян, свиней, носорогов, медведей, кроликов и птиц и др.
(Рис. 4).
Систематика, таксономия, классификация Malassezia spp. Систематическое положение малассезий можно представить в следующем виде:
Надцарство (Supraregnum) – Eukaryota
Царство (Regnum) – Fungi
Отдел (Divisio) – Basidiomycota
Подотдел (Subdivision) – Ustilaginomycotina
Класс (Classis) – Exobasidiomycetes
Порядок (Order) – Malasseziales
Род (Genus) – Malassezia
Вид (Species) – Malassezia species (13 анаморфных видов)
Род Malassezia состоит из 13 видов возрастающей важности для медицины и ветеринарии. У людей они ассоциируются с PV, себорейным дерматитом (SD), фолликулитом (F) и системной инфекцией; у животных зоофильными видами признают M. caprae, M. nana, M. dermatis, M. cuniculi.
Липидозависимыми являются: M. dermatis, M. furfur, M. globosa, M. japonica, M. obtusa, M. restricta, M. slиooffiae, M. sympodialis, M. yamatoensis и недавно открытый вид М. сuniculi sp. nov.
Морфолого-биологические особенности малассезий.
M. pachydermatis – единственный липидонезависимый вид этого рода. Все другие виды рода Malassezia являются липидозависимыми, не способными заново синтезировать С14 или С16 жирные кислоты. Поэтому для них необходим внешний источник липида, но, точно не зная сущности дела, исследователи много лет не могли культивировать малассезии in vitro. Впервые сообщившей о необходимости внесения в питательную среду липидной добавки для роста этих грибов была Р. Бенгем [17].
Malassezia spp., как и ряд дрожжевых микромицетов, проявляют диморфизм. И если ранее исследователи предполагали, что дрожжевая фаза является самостоятельным родом, ими названным Pityrosporum, то мицелиальная фаза получила название Malassezia. Только в 1977 г. было доказано, что обе фазы могут переходить одна в другую, и, следовательно, диморфизм Malasseziа – явление реальное, поэтому название Pityrosporum осталось в прошлом. Факторами, индуцирующими конверсию фаз, являются глицин, сквален и холестерин:
Однако не все виды и штаммы, очевидно, могут подвергаться вышеназванной фазовой конверсии. Виды Malasseziа биохимически относительно инертны и обладают сравнительно утолщённой клеточной стенкой, окружённой пластинчатым или капсулоподобным слоем, содержащим липиды, который может быть удалён растворителями.
Malasseziа spp. продуцируют ряд метаболитов, включая γ-лактоны, придающие этим микромицетам характерный фруктовый запах. Когда их выращивают на среде с олеиновой кислотой (С17Н33СООН) или СН3–(СН2)7–СН=СН–(СН2)7–СООН, то дополнительно к другим дикарбоксильным кислотам продуцируется азелаиновая кислота (С9Н16О4), или нонандиовая кислота, или 1,7 – гептандикарбоновая кислота: НООС–(СН2)7–СООН.
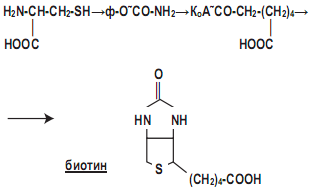
Азелаиновая кислота выступает ингибитором нейтрофилов, вызывая сниженную продукцию кислородных радикалов, и является конкурентным ингибитором тирозиназы — ключевого фермента в меланогенезе, обосновывая размышление о том, что данная кислота может быть важной в изменениях пигментации кожи, наблюдаемой при разноцветном лишае. Она же может подвергаться ß-окислению с образованием предшественника биотина (ранее – витамин В7) пимелиновой кислоты по следующей схеме: цистеин → карбамоилфосфат → пимелил-КоА → биотин, или
M. furfur обладает пониженной чувствительностью к ультрафиолетовому облучению (УФО) благодаря способности синтезировать производные триптофана. Оказалось, что данному виду присущ триптофан-зависимый синтез пигментов и флуорохромов [25]. Возможное значение этого метаболического пути для микроорганизма остаётся до конца не исследованным. На модифицированном агаре Диксона, в котором пептон замещали L-триптофаном, были выращены три вида – M. furfur, M. sympodialis, M. pachydermatis. Из них первый (разные штаммы) всегда образовывал пигмент; второй – не отличался постоянством в пигментообразовании; разные штаммы третьего никогда не проявляли способности продуцировать пигмент. Отметим, что пигментогенез у M. furfur индуцируется триптофаном в такой небольшой концентрации как 0,01 г%. Поскольку у человека наружная часть эпидермиса является
естественной средой обитания M. furfur, постольку повышенная экспозиция к ультрафиолетовому облучению (УФО) может быть для людей опасной вследствие возможности развития Malassezia spp. Таким образом, пигмент-образующие малассезии защищаются от УФО in vitro благодаря синтезу пигментов типа индольных алкалоидов [26]. Из других (кроме тирозиназы) ферментов малассезии образуют также сравнительно широкий их набор – различные гидролазы, оксидоредуктазы, синтетазы и пр. Например, теперь известен ген у M. furfur MfLIP1, кодирующий белок с (молекулярной массой (ММ) 54,3 кДа и оптимальным рН 5,8 в реакции гидролиза твинов (твины 20, 40,60, 80 – это полиэтилен(20)-сорбитан-эфиры), часто используемых в питательных средах в качестве источников липидов. Фланкирующим MfLIP1 оказался ген, кодирующий синтез каталазы, способной секретироваться во внеклеточную среду. Очевидно верно предположение, что активность in vitro фосфолипазы А2 у M. furfur может сопровождаться выделением арахидоновой кислоты с 20 атомами углерода:
СН3(СН2)4СН=СНСН2СН=СН-СН2СН=СН-СН2СН=СН(СН2)3СООН
Уреаза и внеклеточная ДНКаза, наряду с не столь широко используемым диазонием голубым В, как правило, всегда позитивны для Маlassezia. Кроме того, представители этого рода продуцируют крахмалоподобные вещества, ассимилируют инозит(ол); сахара, как правило, не ферментируют; почкование среди малассезий обычно распространено. Репродукция в поколениях обычно происходит после спаривания соответствующих партнёров. Мицелий толстостенный, клеточные стенки многослойные, септы имеют долипоры или простые поры. Меланин-образующие грибы менее чувствительны к реактивным кислородным радикалам; продукция меланина выступает одним из важных факторов агрессии не только малассезий, но и, например, криптококков – двух родов базидиомицетовых дрожжей. Альтернативные триптофану источники аминного азота обычно супрессируют пигментогенез. Кроме того, отдельные штаммы M. furfur могут проявлять себя неравноценно по выработке пигмента, например, штаммы СBS №№ 6000, 6001 и 7019 неспособны продуцировать пигмент при 37 °С. Это следует иметь в виду при работе с различными культурами данного и других видов Malassezia. Допустимо предположение о том, что при изменении качества и количества источников азота на коже при PV возможна метаболическая адаптация малассезий к изменившимся условиям, что приобретает патофизиологическое значение. К тому же, триптофан может накапливаться при избыточной потливости, имеющей место в процессе развития PV, а триптофан – индуктор пигментогенеза. Выборочная характеристика малассезий приведена в таблице 1.
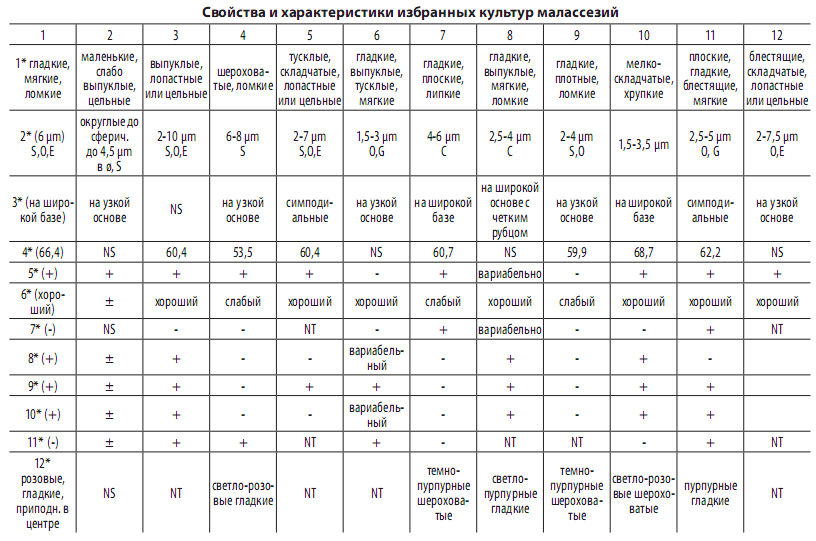
Примечания: 1–12 — Malassezia:1 — M. furfur, 2 — M. caprae, 3 — M. dermatis, 4 — M. globosa, 5 — M. japonica, 6 —
M. nana, 7 — M. obtusa, 8 — M. pachydermatis, 9 — M. restricta,10 — M. slooffiae,11 — M. sympodialis, 12 – M. jamotoensis.
1*-12*-Свойства и характеристики: 1*- морфология колоний и текстура, 2*-размер клеток и форма, 3*-способ почко-
вания, 4*-% Г+Ц,5*-каталаза, 6*-рост при 37 оС, 7*-способность расщеплять эскулин, 8*-рост с твином 20, 9*-рост с твином 40 и 60, 10*-рост с твином 80, 11*- преципитат на среде Диксона(ПД), 12*- колонии на модифицированном хром-агаре. NS- не изучали; NT- не определяли; Форма клеток: S – шаровидная, О – овальная, G – глобулярная, Е – эллипсовидная,
С – цилиндрическая. (+) – позитивная, (-) – отрицательная.
При выращивании малассезий применяют также так называемый кремофор ЕL (зарегистрированная торговая марка BASF корпорации для своей версии полиэтоксилированных касторовых масел, смешивая 35 молей окиси этилена с одним молем касторового масла). Кремофор ЕL является синтетическим неионогенным поверхностно-активным веществом (ПАВ), способным стабилизировать эмульсии неполярных материалов в водных системах. В его присутствии хорошо растёт М. dermatis и, вариабельно, M. pachydermatis. В качестве селективной среды для малассезий используют также агаризованную среду Лиминга и Нотмана (Leeming and Notman), содержащую 10 г бактериологического пептона, 5 г глюкозы, 1 мл глицерина, 0,5 мл твина-60, 10 мл цельного (неснятого) коровьего молока, 0,1 г бычьей желчи, 12 г агара; все названные ингредиенты вносят в 1 л дистиллированной воды. Среду стерилизуют автоклавированием при 110 °С в течение 15 мин.
Оценка различных методов предохранения и сохранения Malasseziа spp.
Замораживание при -80 °С, лиофилизация, предохранение в дистиллированной воде и сохранение в различных культуральных средах можно проводить в целях выбора подходящего метода, который обеспечил бы длительное сохранение Malasseziа spp. В обычных лабораторных условиях малассезии необходимо пересевать, по крайней мере, один раз в месяц на соответствующие питательные среды.
Замораживание при -80 °С, последующее лиофильное высушивание и сохранение при -80 °С в параллели с сохранением при комнатной температуре оказалось тем методом, с помощью которого успешно поддерживаются виды названного рода [27].
Из других способов сохранения культур Malasseziа spp. опробованы: предохранение в дистиллированной воде и на различных питательных средах при +4о С, при комнатной температуре и при +28 о С; в случаях замораживания при -80 о С используют также диметилсульфоксид и глицерин в качестве криопротекторов в концентрациях 5 и 10(об%) объёмных процентов соответственно. Штаммы М. pachydermatis выращивают на агаре Сабуро с глюкозой (допустимо + левомицетин [28, 29]) при 35 о С в течение 3-5 суток, а липидозависимые виды – на агаре Диксона или солевом агаре при 32 о С в течение 5-7 суток. Агар Диксона включает: солодовый экстракт – 18,9 г, пептон – 18 г, агаг-агар – 7,25 г, обезвоженную бычью желчь – 10 г, твин-40 – 5 мл, глицерина моноолеат – 2,5 мл, дистиллированную воду – 500 мл. Изготовление агара начинают с увлажнения частью воды названных выше ингредиентов, а остальную часть воды нагревают единожды до кипения и вносят в ёмкость с увлажнёнными ингредиентами, смешивают и стерилизуют при 121 о С в течение 10 мин. Затем разливают, например, по пробиркам и скашивают до застывания косячков среды; на среде можно выращивать культуры малассезий или патологический материал, например, чешуйки кожи от пациента с PV. Изоляты малассезий могут быть позитивными от 50 до 70% со следующим распределением по видам: Malassezia sympodialis – до 29%, M. globosa – до 19%, M. restricta и M. sympodialis – по 2%. Однако среди изолятов могут отсутствовать M. furfur, M. pachydermatis и M. slooffiae. Солевой агар, или солетолерантная среда содержит 20 г глюкозы, 10 г дрожжевого экстракта, 10 г агар-агара и 1 л дистиллированной воды с добавлением 110, 120 или 130 мг натрия хлорида (NaCl). Среду стерилизуют при 121 о С в течение 15 мин., а затем разливают в чашки Петри (Ǿ≈9 см) и оставляют до застывания при комнатной температуре. Агар Сабуро с глюкозой + оливковым маслом (10 мл/л среды) также применяют для сохранения культур липидозависимых малассезий. Окончательные концентрации клеток для хранения могут быть разными, но чаще используют 104 клеток/мл. Трудные для выращивания на питательных средах M. globosa, M. obtusa и M. restricta лучше сохранялись, будучи подвергнуты замораживанию при -80 о С (равно как и другие виды Malassezia). Снятое молоко в комбинации с криопртекторами, например, с глицерином,
является хорошим субстратом для малассезий, особенно – липидозависимых. В экспериментах с животными [30] показано, что M. рachydermatis целесообразно поддерживать и хранить культуры возбудителя в лабораторных условиях на среде Барфатини. В различных исследованиях было установлено, что в принятых теперь видах Malassezia выявлены подгруппы: 2,4 или 8 – у M. furfur, 4 – у M. pachydermatis и 4 – у M. sympodialis [31-34]. Не исключена возможность, что после накопления дополнительных материалов о названных подгруппах отдельные из них приобретут статус самостоятельных видов в составе рода Malassezia. Примером тому служит работа испанских исследователей Cabañes, Vega, Castella из Барселоны [9], изучавших липофильную микобиоту кожи кроликов, и выделивших два новых липидозависимых изолята. В начале изоляты не могли определить, поскольку они не вырастали на глюкозном агаре Сабуро, модифицированном агаре Диксона и на агаризованной среде LN. Проявив настойчивость, авторы добились своей цели и описали новый таксон Malassezia сuniculi sp. nov., выросший через 7 суток на среде LN при 32 о С в форме очень маленьких колоний (0,5-1 мм в ø), по цвету беловатые – до кремовых, тусклые, с восковидностью. К настоящему времени изучены его морфолого-физиологические характеристики. Достоверность нового вида обоснована результатами анализа D1/D2 регионов 26 рРНК-генов и ITS – 5,8 S р-РНК – генных последовательностей. Этими исследованиями подтверждены самостоятельность этого нового вида и его оригинальность; он отличается от всех ранее описанных малассезий, его ассоциируют с лагоморфами. Лагоморфы – это члены таксономического порядка Lagomorpha, их два семейства существуют и в настоящее время: 1. Laporidae –объединяет зайцев и кроликов и 2. менее распространённый – Ochotonidae (мелкие грызуны – «пискуны» («пищалки»), обитающие в холодных климатических условиях преимущественно в Азии, Северной Америке и в некоторых частях Европы (большинство видов обитают на склонах скалистых гор в норах); третье семейство – Prolagidae относят к вымершим. Представители первых двух могут быть носителями малассезий в качестве нормобиоты или микромицетов – патогенов (Рис. 4). Группа бразильских учёных (Дуарте, Резенде и Гамдан) [35] выполнили и опубликовали результаты изучения типичных (липидозависимых) – M. nana и M. sympodialis, и двух атипичных (липидозависимых) штаммов M. paсhydermatis, выделенных из ушей крупнорогатого скота и собак, используя метод «случайно приумноженных полиморфных ДНК», или RAPD-анализ. Полученные данные в RAPD-анализе сравнивали с физиолого-биохимическими характеристиками, ранее также использованными для идентификации отобранных штаммов Malasseziа spp. Авторы установили факт сходства типичных и атипичных липидозависимых малласезий, но это не доказывается одной специфической полосой из 200 пар нуклеиновых оснований в ДНК-образцах.
Всего 30 изолятов малассезий из ушей крупного рогатого скота и собак были идентифицированы по морфологическим характеристикам, росту на среде Диксона при разных температурах, на среде Сабуро с добавлением твинов и кремофора EL в диффузном тесте, по гидролизу эскулина и скринингу каталазы. Эскулин относят к группе кумаринов – типичных продуктов обмена веществ высших растений, но некоторые микроорганизмы, например плесневые грибы, образуют весьма токсичные для печени кумариновые производные – афлатоксины.
Кумаринрвая кислота образуется при ферментативном отщеплении глюкозы от молекулы кумарина с такими промежуточными соединениями, как ß,Dглюкозид О- кумариновой кислоты (а), ß,D-глюкозид О- кумаровой кислоты (б), О- кумаровой кислоты (в) и транс-коричной кислоты (г):
Афлатоксины, или флавотоксины имеют поликетидную проироду, и в качестве примера мы приводим строение афлатоксина G1.
Каталаза – фермент первого класса и отнесена к группе оксидо-редуктаз, катализирующих реакции окисления-восстановления по схеме: Sred + S’ox = Sox + S’red .
Для выполнения RAPD-анализа приготавливали ДНК из малассезий после их ферментативного переваривания глюканазой (Glucanex-Novo Nordisk, USA). Были использованы следующие праймеры: M13F, M13R, M13FR, OPA1, OPA2, OPA4, SOY, 8L и 10 L. RAPD – продукты анализировали электрофорезом в 8% полиакриламидном геле (ПАГ) в трисборатном ЭДТА буфере с рН 8,0 и визуализировали серебром по Sanios c коллегами [36].
В качестве примеров приводим состав трёх праймеров, обладающих наиболее полиморфными и репродуктивными профилями:
M13 F (5’ – TGACCGGCAGAAAATG-3’),
ОРА 2 (5’ –TGCCGAGCTG-3’),
OPA 4 (5’ – AATCGGGCTG-3’)
Всего было получено 15 электрофоретических профилей на 8% ПАГ и отобраны их фенограммы, анализом которых, поддержанным значениями величин распределения полос более чем на 80%, показано, что RAPD-patterns (образцы) полос при использовании праймера ОРА 4 все изоляты группировались согласно их физиолого-биохимических характеристик. В случаях применения праймеров М13 F и ОРА 2, то 83,4% изолятов также группировались согласно их физиолого-биохимических свойств. В данном исследовании показано, что RAPDанализ должен быть важным методом для характеристики и идентификации атипичных штаммов в роде Malassezia. Это было подтверждено сиквенированием рДНК D1/D2 доменов названных атипичных изолятов малассезий. Все изоляты M. sympodialis (в эту же группу включена и M. cuniculi sp.nov.) имели специфическую полосу около 400 bp нуклеиновых оснований.
M. furfur имеет два субтипа суб-групп в отдельных суб-ветвях (b и d) соответственно. Наличие интра-видов RAPD суб-типов предопределяет различные популяции M. furfur и M. pachydermatis, которые были родственными и по данным других исследователей [31 и 33].
В настоящее время уже сформировалось мнение о том, что имеет место снижение числа случаев «разноцветного лишая» в мире у лиц старше 30-летнего возраста, и это связано с приобретенным иммунитетом, хотя механизм его проявления остаётся ещё не вполне ясным. Почти все здоровые взрослые люди имеют небольшое количество IgG к M. furfur в сыворотке крови (исключения из правил бывают единичными). IgG-антитела обнаруживают в сыворотке крови у здоровых волонтёров, а у пациентов с PV титры антител несколько выше, чем у лиц в контрольных группах.
В заключение можно подчеркнуть, что ныне специалисты – микологи безусловно знают, что малассезиоз – это:
• хроническое «мягко» протекающее нарушение кожи;
• всемирно распространённое, асимптоматическое заболевание, характеризующееся образованием кожных чешуек разного цвета (розового, белого или коричневого), отпадающих с верхней части туловища; перхоть (D) и SD вместе этиологически зависят от трёх факторов – секрета сальных желёз (сало), микробного метаболизма (специально – Malassezia spp.) и индивидуальной чувствительности; установлено, что M. globosa и M. restricta преобладают на чешуйках перхоти со скальпа, что одна олеиновая кислота может инициировать десквамацию, подобную перхоти; что M. globosa наиболее вероятно делает это за счёт своей высокой липазной активности, проявляющейся на скальпе человека;
• инфекция, вызываемая дрожжевыми организмами из рода Malassezia, ныне включающего 13 видов, изолированных от представителей теплокровных в царстве Animalia; в лабораторных условиях малассезии должны подвергаться субкультивированию ежемесячно;
• патология, индуцируемая анаморфными базидиомицетовыми дрожжами, телеоморфа которых ещё не описана; различные виды малассезий идентифицируют по морфолого-физиологическим параметрам, включая использование ими комплекса липидных источников, а также по данным молекулярно-генетических анализов; отметим также, что для клеток данного рода характерен так называемый «воротничок» (см. Рис 3);
• с эпидемиологической точки зрения – типичная инфекция детей и молодых взрослых лиц, ассоциирующаяся с гормональными изменениями и возросшей продукцией кожного жира;
• инфекционное заболевание, возбудители которого предпочтительно обитают при высоких температуре и влажности, особенно – в тропических зонах;
• поверхностные оппортунистические и, реже, системные инфекции; к поверхностным относят: разноцветный (отрубевидный) лишай, себоррейный дерматит, атопический дерматит, перхоть, фолликулит.
• В 2000 г. V.A. Morrison и D.J. Weisdorf опубликовали материалы о спектре малассезиоза у 3044 лиц с трансплантатами костного мозга, оперированными в Миннесотском университете (США) за период свыше 25 лет [37].
У 6 пациентов в возрасте от 1 года до 54 лет развился малассезиоз, в среднем, через 59 дней после трансплантации. Пять пациентов были аллогенными реципиентами трансплантатов, остальные подвергались автотрансплантации.
Спектр клинических проявлений малассезиоза у этих больных включал инфекции слизистых оболочек и кожи, катетер-обусловленных фунгемий. В отличие от многих других, более заурядных оппортунистических инфекций, у иммунокомпрометированных пациентов, с нейтропенией и использованием антимикробных средств широкого спектра действия, эти факторы не представляют собой значительного риска развития малассезиоза у популяции лиц с костно-мозговыми трансплантатами.
Кроме того, диссеминированная грибковая инфекция, несмотря на наличие фунгемии, является необычной.
Наконец, исход малассезиоза у этих пациентов с фолликулитом, инфекцией слизистых оболочек или фунгемией, кажется, должен быть вполне благоприятным (в противоположность плохого исхода с многими другими грибковыми инфекциями у пациентов с трансплантатами костного мозга). Случаи с удалёнными катетерами и прекращением внутривенного введения липидов являются важными, чтобы подчеркнуть удачные исходы для пациентов с фунгемиями при малассезиозе.
• Катетер-приобретенный малассезиоз, индуцированный M. furfur, проходит с удалением катетера; при этом нет необходимости вводить химиотерапевтическое средство через инфицированный просвет кровеносного сосуда даже тогда, когда названный патоген чувствителен, например, к азоловым препаратам или амфотерицину В.
Из многих способов обработки поражённых мест при малассезиозе наиболее удачными признают те, которые сопровождались исчезновением элементов гриба в патологическом материале в течение последующего месяца; наличие чешуек и любых изменений в пигментации кожи служит основанием для продолжения лечебного воздействия на продолжающийся процесс болезни;
по-прежнему считают эффективным селена сульфид (SeS2) в виде 2,5% водного раствора для местного применения (наносят раствор на поражённую поверхность, выдерживают 10-20 мин., хорошо промывают водой во избежание раздражения от остатков лекарственного средства).
Альтернативными препаратами считают 30% водный раствор натрия сульфата (Na2SO4) – 2 раза в день,
2% серную мазь, толнафтат или кремы с имидазолом.
Пациентам с обширными поражениями или ежегодными повторами отрубевидного лишая рекомендуют приём кетоконазола внутрь 200 мг в день в течение 2 недель.
Из других средств называют йодид калия, флуконазол с криотерапией, шампунь с цинком пиритионом, тербинафин, циклопирокс и др.
Применительно к малассезиозу у животных особого упоминания заслуживает M. pachydermatis – вид липофильный, но не липидозависимый (за исключением некоторых штаммов).
В 2008 г. выполнена диссертационная работа [30], в которой разнопланово исследована роль малассезий при заболеваниях кожи у животных. Автор обнаружил малассезии в слуховом канале у 29,6% здоровых собак и у 88,2% собак с проявлениями хронических отитов. Возникновение и развитие малассезиозов напрямую зависит от возрастания плотности патогена в слуховом канале в сравнении со здоровыми животными.
Основным возбудителем малассезиоза у собак и кошек была M. pachydermatis – в 52,4% случаев, в ассоциации с бактериями – в 25,2% случаев, в ассоциации с другими грибами – в 2,8% случаев. LD50 для белых мышей, в эксперименте при внутрибрюшинном введении, составила 1,41-2,45 млрд./ клеток в зависимости от штамма;
при накожном заражении собак M. pachydermatis способна вызывать развитие сквамозного дерматита.
Липофильные и/или липидозависимые малассезии устойчивы к беномилу [38] – фунгициду с блокирующим митоз и деление клеток действием у многих аскомицетов и митомицетов, или дейтеромицетов. Его брутто-формула С14Н18N4O3. По химическому строению беномил является производным бензимидазола с рациональным названием: метил (бутил-карбамоил) бензимидазол-2-илкарбамат (1 — (бутил-амино) карбонил) — 1Н – бензимидазол – 2 — ил), метиловый эфир карбамовой кислоты. Его молекулярная масса =290,32. беномил H H3C-(CH2)3-N N N C=O N H CH3 C=O O Коммерческие препараты беномила обозначают как «500 беназол», «500 фундазол, «500 бенорад», «500 альтернатива». Отметим второй – фундазол как 500 СП – универсальный фунгицид защитного системного действия от грибных фитопатогенов, но он не эффективен в отношении малассезий. Можно предполагать, что на базидиальные грибы он не действует вообще. Однако в этом направлении необходимы дополнительные исследования. Очевидно, что изучение биологии представителей рода Malassezia далеко не завершено, и поэтому апробированные средства и методы лечения разных форм заболевания остаются не всегда и не во всём совершенными.
ЛИТЕРАТУРА
1. Inamadar A.C., Palit A. The genus Malassezia and human disease // Indian J. Dermatol. Venereol. Leprol. 2003. – Vol. 69,
N4. – P. 265-270; http: //en.wikipedia.org/wiki/Malassezia. 05.12.2010. – p.1-4.
2. Freedberg et.al. Fitzpatrick’s Dermatology in General Medicine (6th
ed.) // McGraw-Hilll. – 2003. – 1187 p.
3. Gueho E., Migley G., Guillot J. The genus Malassezia with description of fourth new species // Antonie Van Leeuwenhoek.
– 2003. – Vol. 69, №4. – P. 337-355.
4. Coutinho S.D., Paula C.R. Diotyping Malassezia pachydermatis strains using the killer system //Rev. Iberoam Micol. –
1998. – Vol. 15, №2. – P. 85-87.
5. DeAngelis Y.M., Saunders C.W., Johnstone K.R., et al. Isolation and expression of a Malassezia globosa lipase gene, LIPI // J.
Invest. Dermatol. – 2007. – Vol. 127, №9. – 2138-2146.
6. Sugita T., Tajima M., Amaya M., Tsuboi R., Nishikawa A. Genotype analysis of Malassezia restricta as the major cutaneous
flora in patients with atopic dermatitis and healthy subjects // Microbiol. Immunol. – 2004. – Vol. 48, №10. – P. 755-759.
7. Uzal F.A., Paulson D., Eigenheer A.L., Walker R.L. Malassezia slooffiae-associated dermatitis in a goat // Vet. Dermatol. –
2007. – Vol. 18, №5. – P. 348-352.
8. Nell A., James S.A., Bond C.J., et al. Identification and distribution of a novel Malassezia species yeast on normal equinane
skin // Veter. Rec. – 2002. – Vol. 150. – P. 395-398.
9. Cabañes F.J., Vega S., Castellá G. Malassezia cuniculi sp.nov., a novel yeast species isolated from rabbit skin // Med. Mycol.
– 2011. – Vol. 49, №1. – P. 40-48.
10. Kwon-Chung K.J. and Bennett J.E. Medical Mycology. – Lea & Febiger, 1992. – 866 p.
11. Robin C. Historie naturelle des végétaux parasites. – Paris: Bailiére, 1853.
12. Malassez L. Note sur le champignon de la pelade // Arch. Physiol. – 1874. – №11.– 203-212.
13. Bizzozero J. Ueber die Mikrophyten der normalen oberhaut des Menschen // Virchows Arch. (A). – 1884. – №98. – Р. 441-459.
14. Baillon H. Traite de Botanique Medica Cryptogamique. – Paris: Octave Doin Editeur, 1889. – Р.234-235.
15. Saburoaud R. Maladies du cuir chevelu. II. Les maladie desquamotives. – Paris: Masson, 1904.
16. Castellani A. and Chalmers A.J. Manual of Tropical Medicine, 2nd
Ed. – New York: Vm. Wood and Co., 1913.
17. Benham R.W. The cultural characteristics of Pityrosporum ovale – a lipophilic fungus // J. Invest. Dermatol. – 1939. – №2.
– Р. 187-203.
18. Gordon M. Lipophilic yeast-like organisms associated with tinea versicolor // J. Invest. Dermatol. –1951. – №17. – Р. 267-272.
19. Burke R.C. Tinea versicolor: susceptibility factors and experimental infection in human beings // J. Invest. Dermatol. –
1961. – №36. – Р. 389-401.
20. Sternberg T.H. and Keddie F.M. Immunofluor escence studies in tinea versicolor // Arch. Dermatol. –1961. – №84. – Р.
999-1003.
21. Keddie F.M. and Shadomy S. Etiological significance of Pityrosporum orbiculare in tinea versicolor // Sabouraudia. – 1963.
– №3. – Р. 21-25.
22. Redline R.W. and Dahms B.B. Malassezia pulmonary vasculitis in an infant on long-termal intralipid therapy // N. Engl. J.
Med. – 1981. – №305. – Р. 1395-1398.
23. Hassal E., Ulich T. and Ament M.E. Pulmonary embolus and Malassezia pulmonary infection related to urokinase therapy
// J. Pediatr. – 1983. – №102. – Р. 722-725.
24. Shek Y.H., et al. Malassezia furfur-disseminated infection in premature infants // Am. J. Clin. Pathol. – 1989. – №92. – Р.
595-603.
25. Mayser P., Wille G., Imcampe A., et al. Synthesis of fluorochromes and pigments in Malassezia furfur by use of tryptophan
as the single nitrogen source // Mycoses. –1998. – №41. – Р. 265-271.
26. Mayser P., Schafer U., Kramer H.J., Irlinger B., Steglich W. Pityriacitrin – an ultraviolet – absorbing indole alkaloid by the
yeast Malassezia furfur // Arch. Dermatol. Res. – 2002. – №294. – Р.134.
27. Crespo M. J., Abarca M.L. and Cabañes F.J. Evaluation of Different Preservation and Storage Methods for Malassezia spp.
// J. of Clinical Microbiolоigy. – 2000. – Vol. 38, №10. – Р. 3872-3875.
28. Елинов Н.П., Васильева Н.В., Степанова А.А., Чилина Г.А. Candida. Кандидозы. Лабораторная диагностика. Под
ред. з.д.н. РФ проф. Н.П. Елинова. – СПб, 2010. – 224 с.
29. Van Abbe N.J. The investigation of dandruff // J. Soc. Cos. Chem. – 1964. – №15. – Р. 609-630.
30. Ершов П.П. Этиологическая значимость дрожжевых грибов рода Malassezia при кожных заболеваниях животных:
Автореф. дисс… канд. вет. наук. – М., 2008.
31. Aizawa T., Kano R., Nakamura Y., Watanabe S., Hasegawa A. The genetic diversity of clinical isolates of Malassezia
pachydermatis from dogs and cats // Med. Mycol. 2001. – №39. – Р. 329-334.
32. Cabanes F.J., Hernandes J.J., Castella G. Molecular analysis of Malassezia sympodialis – related strains from domestic
animals // J. Clin. Microbiol. – 2005. – №43. – Р. 277-283.
33. Boekhout T., Kamp M., Gueho E. Molecular typing of Malassezia species with PFGE and RAPD // Med. Mycol. – 1998. –
№36. – Р. 365-372.
34. Theelen B., Silvestri M., Gueho E., et al. Identification and typing of Malassezia yeasts using amplified fragment length
polymorphism (AFLP), random amplified polymorphic DNA (RAPD) and denaturing gradient gel tltctrophoresis (DGGE)
// FEMS Yeast Res. – 2001. — №1. – Р. 79-86.
35. Duarte E.R., Resende C.P., Hamdan J.S. Characterization of typical and atypical Malassezia spp. from cattle and dog by
random amplified polymorphic DNA analysis // Arq. Inst. Bioil. – 2009. – Vol.76, №2. – P. 157-164.
36. Santos F.R., Pena S.D., Epplen J.T. Genetic apopulation study of a y-linked tetranucleotide repeat DNA polymorphism with
a simple non-isotopic technique // Human genetics. – 1993. – №90. – P. 655-656.
37. Morrison V.A. and Weisdorf D.J. The spectrum of Malassezia infections in the bone marrow transplant population // Bone
Marrow Transplantation. – 2000. – №26. – P. 645-648.
38. de Hoog G.S., Guarro J., Gene J., Figueras M.J. Atlas of Clinical Fungi. – CBS, 2009.

